10 abril, 2025
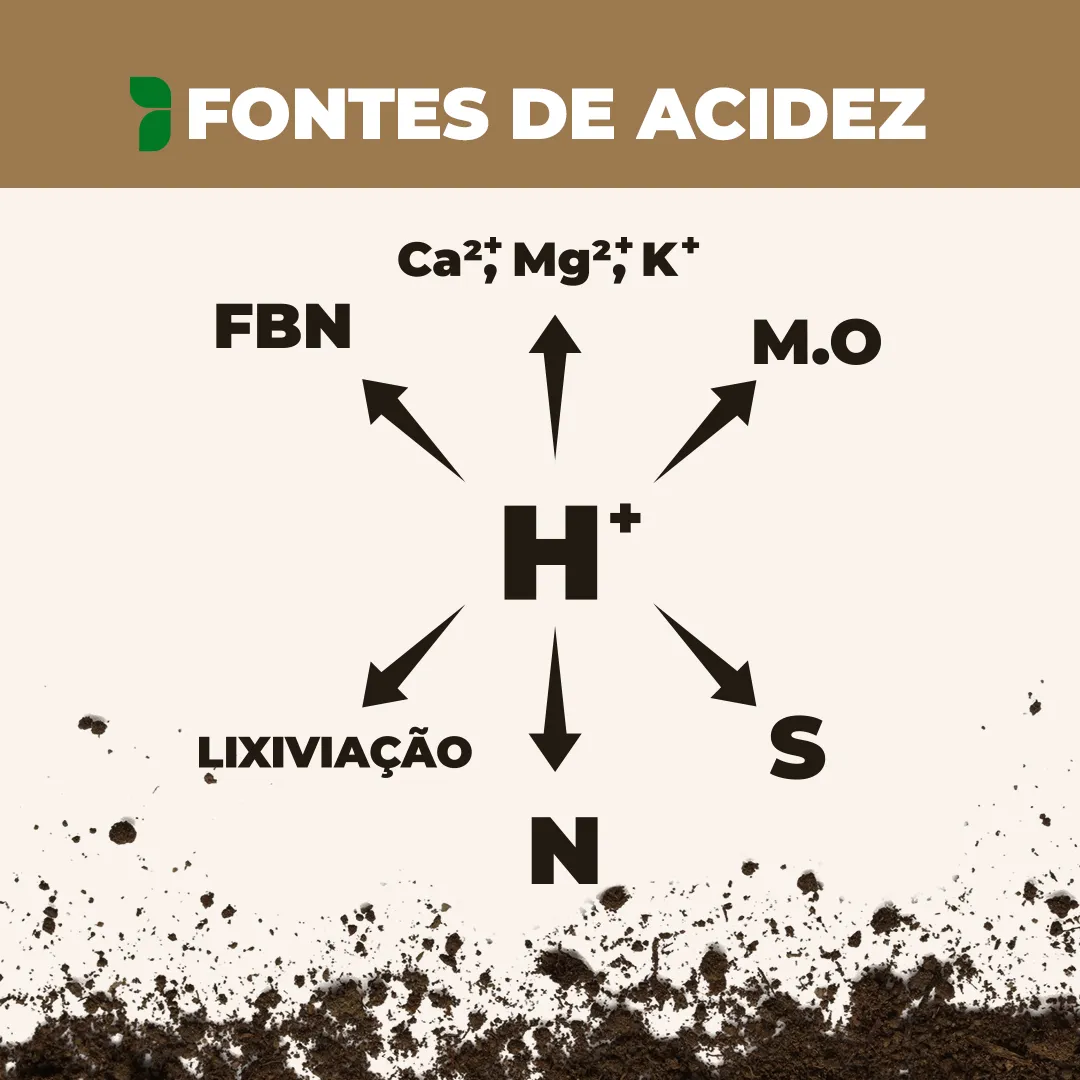
Principais fontes de geração de acidez
Você sabe quais as fontes geradoras de acidez? Quanto cada uma gera? Tudo isso e muito mais no texto sobre as fontes de geração de acidez de solo!
Já discorremos aqui sobre o que é acidez de solo e os seus impactos negativos na produtividade agrícola. A Ferticorreção preza o controle da acidez de solo, mas pra isso é preciso sabermos o que está gerando acidez no sistema. Por isso, elencamos as principais fontes de acidez e como elas acontecem.
1 - EXPORTAÇÃO DE BASES
A Capacidade de Troca Catiônica (CTC) representa a aptidão do solo para reter e trocar cátions com a solução do solo, influenciando diretamente a disponibilidade de nutrientes para as plantas. Os coloides do solo, predominantemente carregados negativamente, desempenham um papel fundamental nesse processo ao atrair e reter cátions como cálcio (Ca²+), magnésio (Mg²+) e potássio (K+), garantindo sua posterior absorção pelas raízes das plantas.
Entretanto, elementos tóxicos, como alumínio (Al³+) e hidrogênio (H+), também podem se associar aos coloides do solo. Quando esses íons ocupam os sítios de troca catiônica, reduzem a disponibilidade de cátions benéficos, comprometendo a fertilidade do solo e diminuindo sua CTC efetiva. Esse fenômeno contribui para a acidificação e a degradação da qualidade química do solo, impactando negativamente o desenvolvimento vegetal e a produtividade agrícola.
A remoção de cátions básicos do solo, seja pela colheita ou pela lixiviação, intensifica esse processo. A exportação de nutrientes como Ca²+, Mg²+ e K+ reduz a fertilidade do solo, favorecendo o acúmulo de íons ácidos. Com a diminuição da concentração de bases trocáveis, ocorre um aumento relativo da presença de íons H+ e Al³+ na solução do solo, acelerando a acidificação e prejudicando a disponibilidade de nutrientes, cada vez mais pobre à medida que acontece mais extração sem reposição.
Desta forma, a reposição das bases cálcio, magnésio e potássio, é extremamente importante para evitar a acidificação do solo. Cada cultura agrícola tem quantidades diferentes de exportação destas bases, sendo necessário a quantificação para posterior reposição.
2 - DECOMPOSIÇÃO DA MATÉRIA ORGÂNICA
A matéria orgânica exerce influência na acidez do solo, principalmente devido à liberação de ácidos orgânicos durante sua decomposição. Esses ácidos, como o ácido fúlvico e o ácido húmico, podem aumentar a concentração de íons H+ na solução do solo, reduzindo o pH e tornando-o mais ácido. Além disso, a matéria orgânica contribui para a complexação e troca de cátions, influenciando a disponibilidade de nutrientes e metais tóxicos. Esse processo pode resultar em uma maior retenção de alumínio e ferro em solos altamente intemperizados, o que também intensifica a acidez.
A decomposição da matéria orgânica, ao liberar nitrogênio no solo, pode, também, causar acidificação. Isso ocorre pela nitrificação do nitrogênio que libera íons H+ no solo.
Por outro lado, a matéria orgânica também pode atuar na neutralização da acidez do solo, dependendo de sua composição e do ambiente em que se encontra. A liberação de ânions orgânicos pode complexar íons H+, reduzindo a acidez, além de favorecer a formação de compostos com cálcio e magnésio, que possuem efeito alcalinizante. Esse efeito tamponante da matéria orgânica é essencial para a manutenção da estabilidade química do solo e para o desenvolvimento das plantas.
Dessa forma, a influência da matéria orgânica na acidez do solo é complexa e depende de fatores como tipo de solo, quantidade de matéria orgânica presente e condições ambientais.
3 - OXIDAÇÃO DO ENXOFRE
A oxidação do enxofre no solo é um processo microbiológico que desempenha um papel importante na acidificação do solo. Esse processo ocorre principalmente quando o enxofre elementar (S) ou compostos reduzidos de enxofre, como o sulfeto de hidrogênio (H₂S) e o tiossulfato, são oxidados por microrganismos.
Durante essa oxidação, o enxofre é transformado em sulfato (SO₄²-), e íons hidrogênio (H+) são liberados como subprodutos da reação, o que contribui diretamente para a acidificação do solo. A liberação dos íons H⁺ ocorre porque, ao oxidar o enxofre elementar, os microrganismos promovem a seguinte reação:
S + 1,5 O₂ + H₂O → H₂SO₄
O ácido sulfúrico (H₂SO₄) formado se dissocia no solo, liberando dois íons H+ para cada molécula de ácido, o que aumenta a concentração de íons hidrogênio no solo e reduz o pH. Quanto maior a quantidade de enxofre oxidado, maior a acidificação potencial. Esse processo é mais intenso em solos bem aerados, úmidos e com boa atividade microbiológica, já que depende diretamente da oxigenação e da presença dos microrganismos oxidantes.
As fontes de enxofre com maior poder acidificante são aquelas que contêm enxofre em formas reduzidas, como o enxofre elementar (S) e o sulfeto de hidrogênio, frequentemente encontrados em solos mal drenados ou em resíduos orgânicos com alto teor de matéria orgânica reduzida. O enxofre elementar, em especial, é amplamente utilizado como “corretivo” em solos alcalinos devido ao seu forte efeito acidificante após a oxidação. Fertilizantes como o sulfato de amônio [(NH₄)₂SO₄], embora contenham enxofre já na forma de sulfato, também contribuem para a acidificação devido à liberação de H+ durante a nitrificação do amônio.
Portanto, o manejo do enxofre no solo deve considerar não apenas sua função como nutriente, mas também seu impacto no pH do solo. Em solos já ácidos, o uso excessivo de fontes altamente acidificantes pode intensificar a necessidade de correção.
4 - FONTES NITROGENADAS
Os fertilizantes são um dos principais agentes de acidificação do solo devido a liberação de íons H+ nas reações químicas. Ureia, nitrato de amônio e sulfato de amônio são fontes de N comumente usadas na agricultura.
Ureia: (NH2)2CO + H2o -→ 2NH3 + CO2
NH3 + H2O -→ NH4+ + OH-
NH4+ + 3/2 O2 → NO-2 + 2H+ + H2O
NO-2 + 1/2O2 → NO3-
Na reação da ureia, a liberação de uma hidroxila acaba neutralizando um íon de hidrogênio, sendo uma fonte não tão agressiva de acidificação.
Nitrato de amônio: NH4+NO3- à NH4+ + NO3-
NH4++ 2O2 à NO3− + 2H+ + H2O
Sulfato de amônio: (NH4)2SO4 à 2NH+4 + SO2-4
NH4+ + 2O2 à NO3- + 2H+ + H2O
Pela concentração de nitrogênio ser menor no sulfato de amônio, necessitando maiores doses, a acidificação deste fertilizante é maior quando comparamos as outras fontes
5 -LIXIVIAÇÃO E ESCORRIMENTO SUPERFICIAL
Nutrientes disponíveis em excesso e/ou sem raízes para serem absorvidos, podem acabar sendo perdidos por lixiviação, principalmente elementos de fácil mobilidade no solo como o potássio. A lixiviação das principais base (cálcio, magnésio e potássio), pode resultar na ligação de um íon de hidrogênio aos coloides negativos do solo e gerar acidificação.
Solos descobertos, sem a presença de plantas ou palhada, também irão perder nutrientes pelo escorrimento superficial do solo. Levando nutrientes para locais onde não tem atividade agrícola, como encostas e rios. Por isso, deixar o solo coberto e, principalmente, com plantas viva, é de suma importância para evitar lixiviação e escorrimento.
6 - FIXAÇÃO BIOLÓGICA DO NITROGÊNIO
A atmosfera terrestre é composta por 78% de nitrogênio em sua forma gasosa (N₂), porém inacessível às plantas. Sendo assim, é preciso ocorrer a transformação do nitrogênio atmosférico em formas assimiláveis pelas plantas.
Bactérias do gênero Bradyrhizobium desempenham esse papel, trocando amônia por oxigênio e alguns compostos derivados da fotossíntese, principalmente a sacarose. Esse processo converte o N₂ presente no ar em nitrato (NO₃-) ou amônio (NH₄+); dessa forma, as plantas conseguem absorver e metabolizar esse elemento. Após a absorção, o nitrogênio é móvel no xilema e floema, sendo transportado na forma de nitrato, aminoácidos ou amidas.
A absorção do nitrogênio pode ser afetada pelo pH do solo, pois a absorção de NH₄+ é prejudicada caso o ambiente esteja ácido, favorecendo a absorção de NO₃-, e vice-versa. Para que a neutralidade elétrica do citoplasma seja mantida, a absorção de NH₄+ resulta na extrusão de um próton (H+) para o meio, fazendo com que o solo seja acidificado. A quantidade de íons H+ (acidificação) gerados pela FBN é muito maior que a quantidade de íons H+ gerada pela decomposição da palhada ou pela acidez livre presente em fertilizantes fosfatados, sendo o principal gerador de acidez na cultura da soja.
Porém, a mensuração da quantidade gerada é muito complexa e há poucos estudos em território brasileiro que mostrem essa acidificação, por isso os valores podem ser variados. Contudo, pode ser gerada uma acidez em torno de 6,8 a 7,1 kmol H+/100 kg N fixados.
Conclusão
Diante das diversas fontes geradoras de acidez no solo, fica evidente que compreender a origem e a intensidade desses processos é fundamental para uma correção eficiente e sustentável da fertilidade do solo. A acidificação não é causada por um único fator, mas sim pelo conjunto de práticas agrícolas que, ao longo do tempo, favorecem a remoção de bases, a oxidação de compostos e o acúmulo de íons H+. Fontes como fertilizantes nitrogenados, oxidação de enxofre, decomposição da matéria orgânica e fixação biológica de nitrogênio podem contribuir significativamente para a queda do pH e o desequilíbrio químico do solo.
Nesse contexto, a quantificação da acidez gerada por cada uma dessas fontes torna-se uma ferramenta indispensável para o planejamento agrícola. Só conhecendo o quanto de acidez está sendo produzido no sistema é que podemos determinar, com precisão, a quantidade de corretivos necessários, como os óxidos de cálcio e magnésio para neutralizar os efeitos negativos sobre o solo e garantir um ambiente favorável ao crescimento das culturas.
A Ferticorreção, portanto, não deve ser vista apenas como uma prática corretiva pontual, mas como um manejo integrado que considera o balanço de nutrientes, a reposição das bases e o controle dos processos acidificantes. Monitorar e controlar a acidez gerada, ajustando doses de fertilizantes de acordo com a exportação e os ciclos biológicos das culturas, é essencial para a construção de sistemas agrícolas mais produtivos, eficientes e sustentáveis. Reiteramos que o controle da acidez de solo é diferente da correção. Fizemos a correção quando trabalhamos em áreas de abertura ou reforma, áreas já em produção é necessário o controle para manter a fertilidade.
REFERÊNCIAS
BRADY, N. C.; WEIL, R. R. Elements of the Nature and Properties of Soils. 4th ed. Pearson, 2019.
BRASIL, E. C.; CRAVO, M. S.; VIÉGAS, I. J. M. Recomendações de calagem e adubação para o estado do Pará. e. – 2. ed. – Brasília, DF: Embrapa, 2020.
Caires EF, Alleoni LRF, Cambri MA, Barth G. Surface application of lime for crop grain production under a no-till system. Agron J. 2005;97:791-8. 2005
Caires EF, Banzatto DA, Fonseca AF. Calagem na superfície em sistema plantio direto. R Bras Ci Solo. 2000;24:161-9. 2000
Caires EF, Barth G, Garbuio FJ, Kusman MT. Correção da acidez do solo, crescimento radicular e nutrição do milho de acordo com a calagem na superfície em sistema plantio direto. R Bras Ci Solo. 2002;26:1011-22. 2002
Caires EF, Garbuio FJ, Alleoni LRF, Cambri MA. Calagem superficial e cobertura de aveia preta antecedendo os cultivos de milho e soja em sistema plantio direto. R Bras Ci Solo. 2006;30:87-98. 2006
FAGERIA, N. K.; BALIGAR, V. C. Enhancing nutrient use efficiency in crop production. Advances in Agronomy, v. 88, p. 97-185, 2005.
HUNGRIA, M.; VARGAS, M. A. Environmental factors affecting N2 fixation in grain legumes in the tropics, with an emphasis on Brazil. Field Crops Research, v. 65, n. 2-3, p. 151-164, 2000.
MARSCHNER, P. Marschner’s Mineral Nutrition of Higher Plants. 3rd ed. Academic Press, 2012.
SOBRAL, L. F. et al. Guia prático para interpretação de resultados de análises de solos. Aracaju: Embrapa Tabuleiros Costeiros. 2015
Sociedade Brasileira de Ciência do Solo. Manual de calagem e adubação para os Estados do Rio Grande do Sul e de Santa Catarina. Comissão de Química e Fertilidade do Solo - RS/SC, 2016
SOUZA. H, A et al. Níveis críticos para atributos do solo pela distribuição normal reduzida em culturas anuais de subsistência. R. Bras. Eng. Agríc. Ambiental, v.18, n.4, p.425–430. Campina Grande, PB. 2014.
Continue lendo nosso blog
Ficou com alguma dúvida?
Entre em contato pelo formulário abaixo.



