
8 abril, 2025
Acidificação do solo por adubos nitrogenados
A acidificação do solo gerada pela adubação com fertilizantes nitrogenados merece atenção! Quanto de H+ é gerado? Como neutralizar?
O nitrogênio é um nutriente essencial para as plantas, sendo um dos mais demandado dependendo da cultura. Com a evolução da agricultura e o advento dos adubos químicos, foi possível aumentar a produtividade das áreas agrícolas. Porém, ao beneficiarmos as culturas com o fornecimento de nutrientes, causamos malefícios ao solo devido a acidificação gerada, principalmente, pelos adubos nitrogenados. No texto a baixo vamos falar sobre esses malefícios, como acontece a acidificação e também como podemos calcular e controlar esse processo de forma mais precisa.
A acidez do solo é um fator limitante na produtividade das culturas, sendo influenciada por diversas práticas agrícolas, especialmente pela aplicação de fertilizantes nitrogenados. Embora o manejo ideal fosse evitar a geração de acidez, essa condição é impraticável na agricultura moderna. Dessa forma, o controle da acidificação passa pela quantificação da acidez gerada e sua neutralização por meio de corretivos, garantindo a sustentabilidade do solo e a produtividade das culturas.
Os fertilizantes nitrogenados, como o nitrato de amônio (NH4NO3), ureia (CO(NH2)2), sulfato de amônio ((NH4)2SO4) e fosfato monoamônico (MAP - NH4H2PO4), têm diferentes teores de nitrogênio e contribuem de maneira distinta para a acidificação do solo. Cada um destes fertilizantes contém teores distintos de nitrogênio e geram acidez de maneira diferente.
A tabela abaixo apresenta a porcentagem de nitrogênio e a geração de acidez em Kmol H+ por 100 kg de nitrogênio aplicado:
FERTILIZANTE | % DE NITROGÊNIO | KmolH+/100kg N |
Nitrato de amônio (NH4NO3) | 32% - 35% | 3,6 |
Ureia (CO(NH2)2 | 45% - 47% | 3,6 |
Sulfato de amônio ((NH4)2SO4 | 20% - 21% | 10,6 |
MAP (NH₄H₂PO₄) | 9% - 12% | 10,0 |
A acidificação ocorre devido às reações químicas no solo que liberam íons H+, tornando o meio mais ácido. No caso do sulfato de amônio, por exemplo, o processo de nitrificação do amônio gera um número significativo de íons H+, o que resulta em uma maior acidificação em comparação com outros fertilizantes nitrogenados. Logo, ao “adicionarmos” íons de H+, acabamos por baixar o pH do solo e diminuir a CTC.
Se estes íons de hidrogênios gerados não forem neutralizados com a adição de hidroxilas (OH-) no solo, o solo será acidificado. E, quanto mais aplicarmos adubos, mais acidez será gerada. É um ciclo de acidez sem fim.
Além dos fertilizantes, processos naturais também contribuem para a acidificação do solo. A fixação biológica do nitrogênio (FBN), comumente observada na cultura da soja, é um exemplo. Para uma produtividade estimada de 60 sacas por hectare (equivalente a 3.600 kg/ha), estima-se a liberação de aproximadamente 12 Kmol H+, contribuindo significativamente para a redução do pH do solo.
Outro fator relevante na acidificação é a extração das bases (Ca2+, Mg2+ e K+) pelas culturas sem a devida reposição. A absorção desses nutrientes pelas plantas reduz a capacidade de troca catiônica (CTC) do solo, favorecendo a ligação das cargas negativas do solo com íons H+ e Al3+, os principais responsáveis pela acidificação.
A geração de hidroxilas para neutralizarmos a acidez é aportada ao solo por meio dos corretivos agrícolas. Nesse grupo se encaixam o calcário (calcítico ou dolomítico) e os óxidos de cálcio e magnésio. Uma opção vantajosa é, também, a utilização dos Ferticorretivos, fertilizantes que irão liberar hidroxilas e neutralizar a própria acidez.
Porém, as recomendações de corretivos dos boletins atuais não levam em conta a acidificação gerada pelos adubos nitrogenados e nem a exportação de bases! A neutralização da acidez, embasada na geração de acidez se torna muito mais eficaz, além de não gerar desperdícios.
Ao conhecermos as quantidades de íons de H+ geradas, bem como a quantidade de hidroxilas fornecidas pelos corretivos, podemos fazer o calculo para neutralizar o balanço de acidificação.
Depois de entendermos como e quanto acidez os adubos nitrogenados geram, precisamos saber qual o aporte de hidroxilas temos que aplicar para neutralizar a equação. A fórmula para este cálculo é:
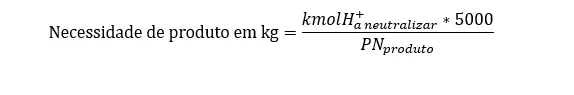
Vamos simular um conta de neutralização com diferentes corretivos de acidez: calcário (PRNT 80%) e óxidos de cálcio e magnésio (PRNT 180)
Adubação de uma lavoura de milho com 400kg/ha de ureia. Em 100kg de ureia eu tenho 45kg de N. Logo, em 400kg de ureia, são 180 kg de N.
100kg N ------- 3,6KmolH+
180 kg N ------- X X=6,48Kmol H+
PN Calcário calcítico: 80
NP = 6,48*5000/80
NP = 32400/80
NP = 405kg/ha
PN óxido de cálcio e magnésio (48% CaO e 34% MgO): 180
NP = 6,48*5000/180
NP = 32400/180
NP = 180kg
Para neutralizar a acidez gerada pela aplicação de 400kg/ha ureia, é necessário aplicar 405 kg/ha de calcário ou 180 kg/ha de óxido de cálcio e magnésio.
A acidificação do solo é um processo inevitável na agricultura, especialmente devido ao uso de adubos nitrogenados e à extração de nutrientes pelas culturas. No entanto, com o conhecimento da acidez gerada por diferentes fertilizantes e a aplicação adequada de corretivos, é possível manter a fertilidade do solo e garantir boas produtividades. A Ferticorreção propõe o controle de acidez baseado na geração do sistema, tornando os processos mais precisos e eficientes. O manejo eficiente da adubação, aliado à reposição equilibrada de nutrientes, é essencial para minimizar os impactos negativos da acidificação e promover a sustentabilidade agrícola.
Referências
FAGERIA, N. K.; BALIGAR, V. C. Enhancing nutrient use efficiency in crop production. Advances in Agronomy, v. 88, p. 97-185, 2005.
HUNGRIA, M.; VARGAS, M. A. Environmental factors affecting N2 fixation in grain legumes in the tropics, with an emphasis on Brazil. Field Crops Research, v. 65, n. 2-3, p. 151-164, 2000.
MARSCHNER, P. Marschner's mineral nutrition of higher plants. Academic Press, 2012.
RAIJ, B. van. Fertilidade do solo e manejo de nutrientes. Piracicaba: International Plant Nutrition Institute, 2011.
Continue lendo nosso blog
Ficou com alguma dúvida?
Entre em contato pelo formulário abaixo.



